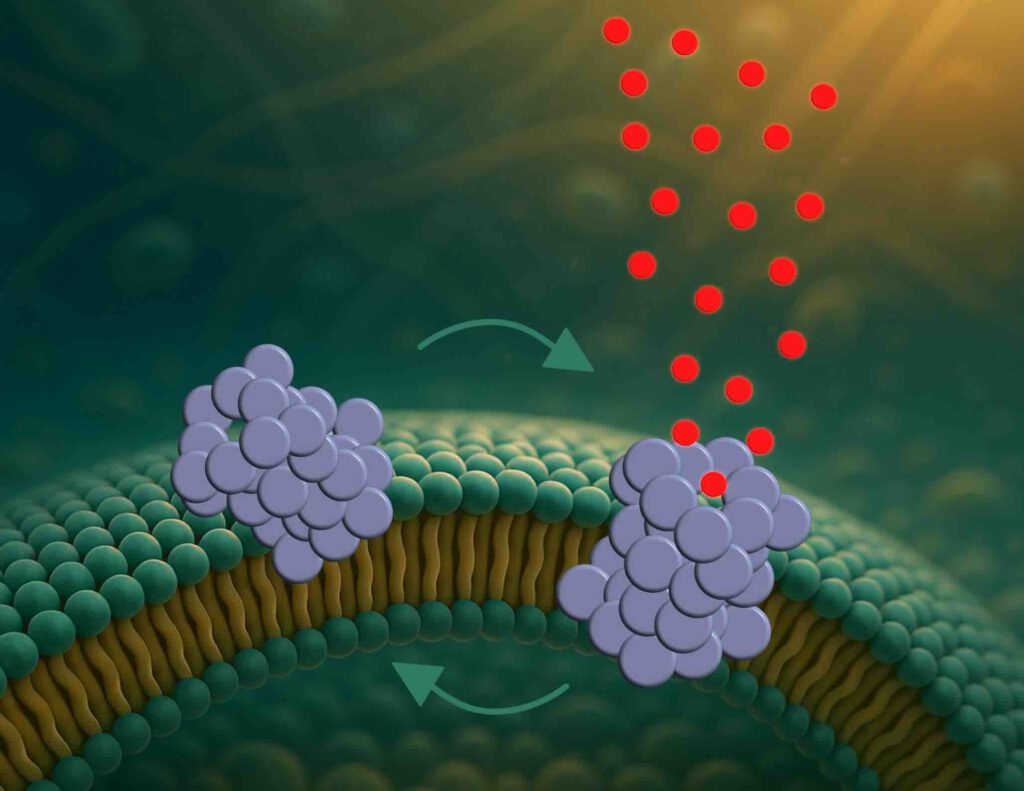
Alfasynucleïneaggregaten (paars) ‘boren’ gaten in hersencellen die dynamisch functionerren (afb: Mette Galsgaard Malle)
Onderzoeksters zouden ontdekt hebben dat bij de ziekte van Parkinson dat eiwitcomplexen gaten ‘boren’ in het membraan van hersencellen. Dat zou ook het ziekteverloop verklaren. Parkinson ontwikkelt zich traag. De cellen gaan niet meteen kapot door die gaten, maar functioneren gaandeweg steeds minder goed.
De ziekte van Parkinson begint vaak subtiel. Een lichte trilling in de hand. Een beetje stijfheid, maar na verloop van tijd beginnen hersencellen af te sterven en verergeren de symptomen. De oorzaak is lange tijd een mysterie gebleven, maar wetenschappers denken nu mogelijk een stap dichter bij een verklaring te zijn.
Bekend was dat het eiwit α-synucleïne een rol speelt in de cel-tot-celcommunicatie in gezonde hersenen. Bij Parkinson begint dat eiwit zich echter abnormaal te gedragen en klontert het samen tot toxische structuren.
Tot nu toe richtte het meeste onderzoek zich op de grote aggregaten die zich vormen, fibrillen genaamd, die zichtbaar zijn in hersenweefsel van patiënten met de ziekte van Parkinson. Een nieuwe studie richtte zich op kleinere, minder goed begrepen en giftigere structuren: α-synucleïne-oligomeren. Volgens de onderzoeksters zijn dit de structuren die microscopisch kleine gaatjes in de membranen van zenuwcellen boren.
“Wij zijn de eersten die direct hebben waargenomen hoe deze oligomeren poriën vormen en hoe die poriën zich gedragen”, zegt Mette Galsgaard Malle, postdoctoraal onderzoekster aan zowel de universiteit van Aarhus als Harvard.
Het proces verloopt in drie stappen. Eerst hechten de oligomeren zich aan het membraan, vooral op gebogen plekken. Vervolgens nestelen ze zich gedeeltelijk in het membraan. Ten slotte vormen ze een porie waar moleculen doorheen kunnen en die mogelijk de interne balans van de cel verstoort.
Die ‘gaten’ zijn dynamisch. De poriën openen en sluiten zich constant als kleine draaideuren.
“Dit dynamische gedrag kan helpen verklaren waarom de cellen niet onmiddellijk sterven”, zegt Bo Volf Brøchner, promovendus en eerste auteur van de studie. “Als de poriën open zouden blijven, zouden de cellen waarschijnlijk heel snel instorten, maar omdat ze open en dicht gaan, kunnen de pompen van de cel dit mogelijk tijdelijk compenseren.”
Dit is de eerste keer dat deze poriedynamiek direct is waargenomen. Dit werd mogelijk gemaakt door een nieuw ontwikkeld analyseplatform voor individuele vesikels, waarmee onderzoeksters interacties tussen individuele eiwitten en afzonderljke vesikels kunnen volgen. Vesikels zijn kleine kunstmatige ‘bootjes’ die voorzien van een membraan en die stoffen transporteren.
“Het is alsof je naar een film in vertraging kijkt”, zegt Galsgaard Malle uit. “We kunnen niet alleen zien wat er gebeurt, we kunnen ook testen hoe verschillende moleculen het proces beïnvloeden. Dat maakt het platform een waardevol hulpmiddel voor medicijnbeproeving.”
Antilichamen
De onderzoeksters hebben al nanodeeltjes – kleine antilichaamfragmenten – getest die specifiek aan deze oligomeren binden. Ze lijken veelbelovend als zeer selectieve diagnostische hulpmiddelen. Of ze ook als medicijn werken is vooralsnog niiet bekend.
“De nanodeeltjes blokkeerden de porievorming niet”, zegt Volf Brøchner. “maar ze kunnen mogelijk wel helpen bij het detecteren van oligomeren in zeer vroege stadia van de ziekte. Dat is cruciaal, aangezien de ziekte van Parkinson meestal pas wordt vastgesteld nadat er aanzienlijke hersenschade is opgetreden.”
De studie toont ook aan dat de poriën niet willekeurig worden gevormd. Ze ontstaan meestal in specifieke membraantypen – met name die welke lijken op de membranen van mitochondriën, de energiefabriekjes van de cel. Dit zou erop kunnen wijzen dat de schade daar begint.
De onderzoeksters moeten bekenen dat de studie is uitgevoerd in modelsystemen, niet in levende cellen. De volgende stap zal zijn om de bevindingen te herhalen in biologisch weefsel, waar complexere factoren een rol spelen. “We hebben een schone experimentele opstelling gecreëerd waarin we één ding tegelijk kunnen meten. Dat is de kracht van dit platform”, zegt Galsgaard Malle. “Nu moeten we de volgende stap zetten en onderzoeken wat er gebeurt in complexere biologische systemen.” Ik(=as) zou zeggen doe dat dan eerst voor je een artikel schrijft.
Bron: Science Daily
