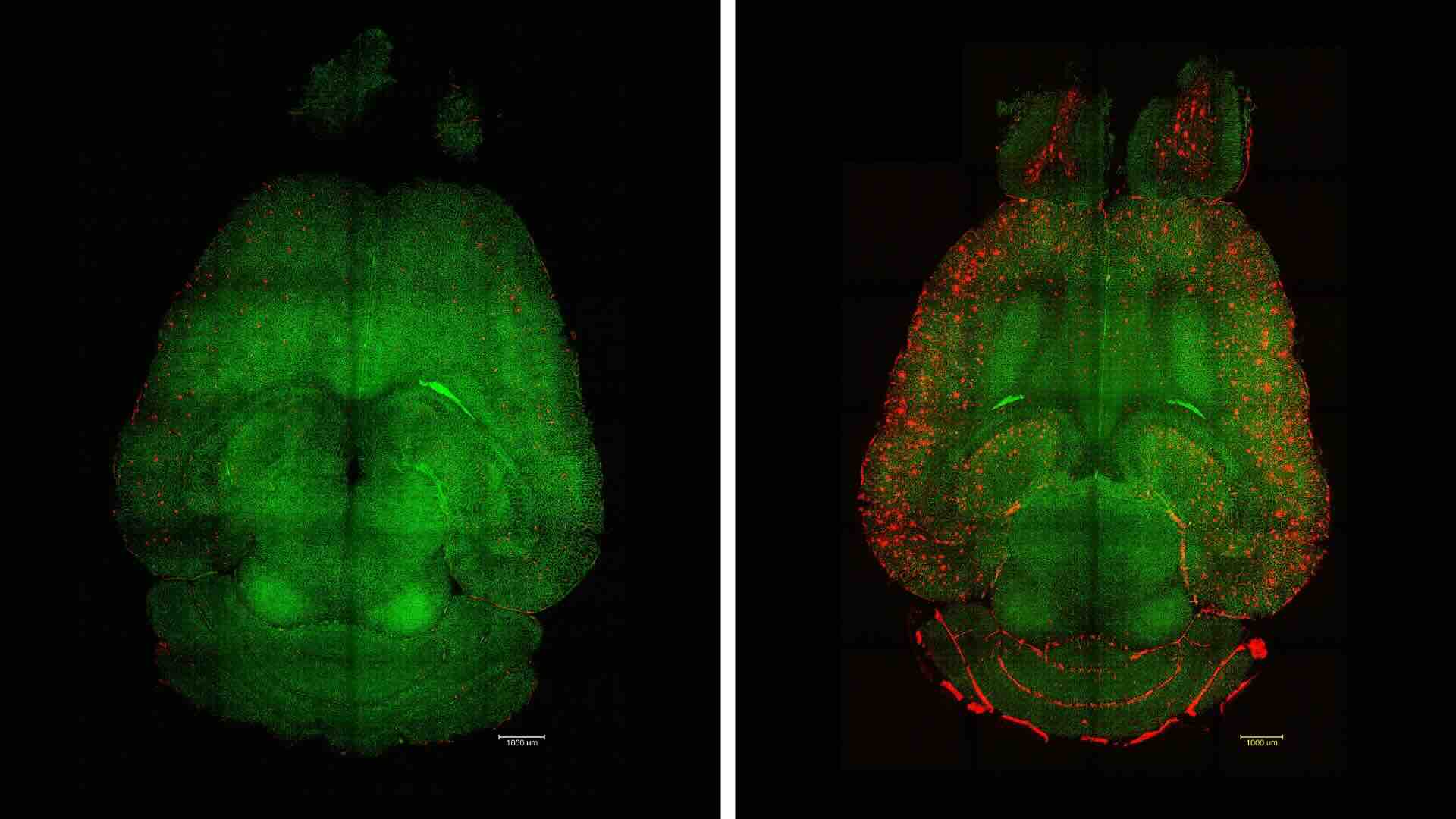
Links een fluorescentiemicroscoopopname van de hersentjes van een muis na twaalf uur na de inspuiting van de nanodeeltjes. Rechts de hersentjes van een onbehandelde Alzheimermuis. Rood aangegeven zijn de beta-amyloïde, groen de haarvaatjes (afb: IBEC)
Bij de ziekte van Alzheimer ontstaan klontering van beta-amyloïde. Onderzoekers gebruikten nanodeeltjes om het vaatstelsel van de hersenen te herstellen en daarmee bij muisjes (een vorm van) Alzheimer terug te draaien. De nanodeeltjes bevorderden de natuurlijke verwijdering van β-amyloïde-eiwitten. Daardoor herstelde de functie van de bloed/hersenbarrière en herstelde het geheugen van de beestjes weer.
Onderzoeker in China, Spanje en het Verenigd Koninkrijk ontwierpen bioactieve nanodeeltjes die functioneren als ‘supramoleculaire geneesmiddelen’ (in het artikel worden die aangeduid met A40POs, wat dat betekent heb ik niet kunnen achterhalen; as). Die zouden de functie van bloed/hersenbarrière hebben hersteld. Dat systeem is bedoeld om de hersenen te beschermen tegen kwalijke invloeden en stoffen.
De hersenen verbruiken ongeveer 20% van de energie die we innemen bij volwassenen en maar liefst 60% bij kinderen. Die energie komt binnen via een uitzonderlijk dicht bloedvatnetwerk waarin elk neuron wordt gevoed door zijn eigen haarvat. Met ongeveer een miljard haarvaten zijn de hersenen afhankelijk van gezonde bloedvaten om te kunnen functioneren en ziekten te weerstaan. Slecht functionerende bloedvaten zouden (mede?) de oorzaak kunnen zijn van aandoeningen zoals dementie en Alzheimer.
Die weerwal is een cellulair en fysiologisch schild dat hersenweefsel scheidt van de rest van het lichaam en helpt bij het blokkeren van ziekteverwekkers en gifstoffen. De onderzoekers toonden aan dat door in te werken op een specifiek mechanisme, schadelijke afvaleiwitten zoals beta-amyloïde die in de hersenen worden geproduceerd, deze barrière kunnen passeren en via de bloedbaan kunnen worden afgevoerd.
De onderzoekers werkten met muisjes genetisch zo waren veranderd dat ze te veel beta-amyloïde aanmaakten. Daardoor gingen allerlei hersenfuncties zoals hun geheugen duidelijk achteruit en ontwikkelden de diertjes kenmerken van Alzheimer.
De muisjes kregen drie doses van de supramoleculaire nanodeeltjes en werden vervolgens goed gevolgd. “Slechts een uur na de injectie zagen we al een afname van 50% tot 60% in de hoeveelheid Aβ in de hersenen”, zegt Junyang Chen van de universiteit van Sichuan en promovendus aan universiteitscollege in Londen (UCL).
In verschillende gedrags- en geheugentests, die gedurende maanden werden uitgevoerd, werden de diertjes in verschillende ziektestadia beoordeeld. In één voorbeeld werd een twaalf maanden oude muis (vergelijkbaar met een 60-jarige mens) behandeld met de nanodeeltjes en 6 maanden later geëvalueerd. Op de leeftijd van 18 maanden (vergelijkbaar met een 90-jarige mens) kwam het gedrag overeen met dat van een gezonde muis.
Langetermijneffect
“Het langetermijneffect komt voort uit het herstel van de bloedvaten in de hersenen”, stelt onderzoeksleider Giuseppe Battaglia. “We denken dat het werkt als een cascade. Wanneer toxische stoffen zoals beta-amyloïde zich ophopen, ontwikkelt de ziekte zich, maar zodra de bloedvaten weer kunnen functioneren, beginnen ze Aβ en andere schadelijke moleculen op te ruimen, waardoor het hele systeem zijn evenwicht kan herstellen. Het opmerkelijke is dat onze nanodeeltjes als een medicijn werken en een terugkoppelmechanisme lijken te activeren dat dit opruimproces weer op een normaal niveau brengt.”
Bij de ziekte van Alzheimer treedt er een belangrijke storing op in het natuurlijke opruimproces van de hersenen voor toxische stoffen zoals beta-amyloïde. Onder normale omstandigheden fungeert het eiwit LRP1 als een moleculaire poortwachter. Het herkent Aβ, bindt het via liganden en helpt het via de de bloed/hersenbarrière naar de bloedbaan te transporteren voor verwijdering.
Dat systeem is kwetsbaar. Als LRP1 te veel Aβ te sterk bindt, raakt het transport geblokkeerd en wordt LRP1 zelf afgebroken in de barrièrecellen, waardoor het aantal beschikbare dragers afneemt. Als de binding te zwak is, is het transportsignaal onvoldoende. Beide scenario’s leiden tot Aβ-ophoping in de hersenen.
De nanodeeltjes fungeren als een herstelknop. Door LRP1-liganden te imiteren, binden ze Aβ, doorkruisen ze de barrière en activeren ze de verwijdering van toxische stoffen. Naarmate dit proces vordert, herwint de vaatwand zijn natuurlijke rol als afvalverwijderaar en keert deze terug naar een normale toestand.
Door het receptortransport op het celmembraan te stimuleren, bieden de deeltjes een nieuwe manier om de receptoractiviteit te beïnvloeden en om de bloed/hersenbarrière te herstellen.
Bron: Science Daily
